Neodimio
| Neodimio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
praseodimio ← neodimio → promezio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalità | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, simbolo, numero atomico | neodimio, Nd, 60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | lantanidi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gruppo, periodo, blocco | —, 6, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densità | 6 800 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | 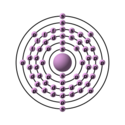 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termine spettroscopico | 5I4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà atomiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Peso atomico | 144,24 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Raggio atomico (calc.) | 181 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | (201 ± 6) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurazione elettronica | [Xe]4f46s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
e− per livello energetico | 2, 8, 18, 22, 8, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stati di ossidazione | 3 (debolmente basico) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struttura cristallina | esagonale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietà fisiche | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stato della materia | solido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di fusione | 1 297 K (1 024 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto di ebollizione | 3 347 K (3 074 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 20,59 × 10−6 m³/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia di vaporizzazione | 273 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di fusione | 7,14 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tensione di vapore | 6,03 a 2 890 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocità del suono | 2 330 m/s a 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Altre proprietà | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numero CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elettronegatività | 1,14 (scala di Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore specifico | 190 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 1,57 × 106 /m·Ω | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità termica | 16,5 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di prima ionizzazione | 533,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di seconda ionizzazione | 1 040 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di terza ionizzazione | 2 130 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia di quarta ionizzazione | 3 900 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopi più stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iso: isotopo NA: abbondanza in natura TD: tempo di dimezzamento DM: modalità di decadimento DE: energia di decadimento in MeV DP: prodotto del decadimento | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Il neodimio è l'elemento chimico di numero atomico 60 e il suo simbolo è Nd.
Indice
1 Caratteristiche
2 Applicazioni
3 Storia
4 Disponibilità
5 Composti
6 Isotopi
7 Precauzioni
8 Note
9 Bibliografia
10 Voci correlate
11 Altri progetti
12 Collegamenti esterni
Caratteristiche |
Il neodimio è un metallo appartenente al gruppo delle terre rare, o lantanidi, presente nella lega chiamata mischmetal fino al 18%.
È un metallo d'aspetto argenteo e lucente, tuttavia essendo uno dei lantanidi più reattivi, si ossida rapidamente all'aria coprendosi di una patina di ossido che desquamandosi espone all'azione ossidante dell'aria nuovi strati di metallo.
Applicazioni |
Tra gli usi del neodimio si annoverano:
- Come componente del didimio, utilizzato per la colorazione degli occhiali e degli schermi per saldatori.
- Negli auricolari ergonomici in cui la presenza di magneti in neodimio offre una qualità sonora eccellente.
- L'utilizzo come colorante per vetri consente di ottenere delicate tonalità che variano dal violetto al rosso-vino sino a tonalità calde di grigio. L'assorbimento di tali vetri presenta picchi di assorbimento particolarmente stretti. Questi vetri sono utilizzati per produrre filtri per osservazioni astronomiche, calibrando le bande dello spettro di assorbimento. Il neodimio consente di compensare il colore verde dei vetri, impartito dal ferro come contaminante.
- Come drogante viene utilizzato in alcuni materiali trasparenti impiegati nei laser all'infrarosso (1054-1064 nm); fra questi, il granato di ittrio e alluminio (Nd:YAG), il fluoruro di ittrio e litio (Nd: YLF), il vanadato di ittrio (Nd: YVO) e nei vetri al neodimio (Nd: glass). Questi ultimi sono usati per costruire i laser a impulsi più potenti del mondo, in grado di fornire potenze dell'ordine del TW per ogni singolo impulso; gruppi di questi laser vengono usati negli esperimenti di fusione nucleare per ottenere il confinamento inerziale dell'idrogeno.
- I sali di neodimio sono usati come coloranti per smalti.
- Il neodimio viene utilizzato per produrre magneti permanenti Nd2Fe14B ad elevata coercitività. Questi materiali sono meno costosi dei magneti al samario-cobalto e vengono anche utilizzati nella produzione di auricolari.
- Probabilmente a causa di affinità con Ca2+, è stato citato l'utilizzo di Nd3+ come agente di crescita per le piante:[1] in Cina è frequente l'utilizzo di composti delle terre rare come fertilizzanti.
- Viene utilizzato per la produzione di altoparlanti di qualità per riprodurre fedelmente le frequenze più alte, ad esempio i tweeter al neodimio si caratterizzano per l'elevata brillantezza del suono.
- Viene utilizzato nella produzione di componenti magnetici di diversi tipi di microfoni professionali per la sua particolare struttura magnetica che assicura una maggiore sensibilità, un miglior rapporto segnale/rumore e una gamma estesa delle frequenze con "alti" limpidi.
Storia |
Il neodimio è stato scoperto dal chimico austriaco barone Carl Auer von Welsbach a Vienna nel 1885. Auer von Welsbach tramite un'analisi spettroscopica individuò il neodimio nel didimio insieme al praseodimio, tuttavia l'elemento non fu isolato in forma pura fino al 1925. Il nome deriva dalle parole greche neos, nuovo, e didimos, gemello.
Oggi il neodimio viene ottenuto tramite un processo di scambio ionico dalle sabbie di monazite ((Ce,La,Th,Nd,Y)PO4), un minerale ricco di elementi appartenenti alla classe dei lantanidi, e per elettrolisi dei suoi sali alogenati.
Disponibilità |
Il neodimio non si trova mai in natura allo stato nativo; si rinviene invece in minerali quali la sabbia di monazite ((Ce,La,Th,Nd,Y)PO4) e la bastnasite ((Ce,La,Th,Nd,Y)(CO3)F), nonché nel mischmetal.
La sua separazione dalle altre terre rare è piuttosto difficoltosa.
Composti |
Tra i composti del neodimio si hanno
Fluoruri
- NdF3
Cloruri
NdCl2; NdCl3
Bromuri
NdBr2; NdBr3
Ioduri
NdI2; NdI3
Ossidi
- Nd2O3
Solfuri
NdS; Nd2S3
Selenuri
- NdSe
Tellururi
NdTe; Nd2Te3
Nitruri
- NdN
Isotopi |
Il neodimio in natura si presenta come una miscela di cinque isotopi stabili, 142Nd, 143Nd, 145Nd, 146Nd e 148Nd, di cui il 142 è il più abbondante (27,2%), e due isotopi radioattivi, 144Nd e 150Nd.
Gli isotopi radioattivi del neodimio sono in totale 31 ed i più stabili sono 150Nd, con un'emivita di 1,1 × 1019 anni, 144Nd (2,29 × 1015 anni) e 147Nd (10,98 giorni). Gli altri isotopi hanno emivite inferiori a 3,38 giorni e la maggior parte di essi inferiore ai 71 secondi.
Questo elemento presenta anche 4 metastati, i più stabili sono 139mNd (emivita di 5,5 ore), 135mNd (5,5 minuti) e 141mNd (62,0 secondi).
La principale modalità di decadimento radioattivo degli isotopi fino a 142Nd è la cattura elettronica con trasformazione in isotopi del praseodimio; per gli isotopi di massa superiore è il decadimento beta con trasformazione in isotopi del promezio.
Precauzioni |
La polvere di neodimio metallico è reattiva all'aria e può incendiarsi spontaneamente.
Come per tutti i lantanidi, i composti del neodimio hanno una tossicità medio-bassa, tuttavia non sono stati condotti studi specifici sulla tossicità del neodimio. La polvere di neodimio ed i suoi sali sono molto irritanti per gli occhi e le mucose e moderatamente irritanti per la pelle. L'inalazione delle polveri può causare embolie polmonari ed un'esposizione prolungata danneggia il fegato. Il neodimio ha anche un effetto anticoagulante sul sangue, specie se somministrato per via endovenosa.
Magneti al neodimio sono stati testati per la realizzazione di supporti per la riparazione delle ossa fratturate, ma problemi di biocompatibilità hanno impedito la diffusione della tecnica.
Note |
^ (EN) Youzhang Wei e Xiaobo Zhou, The Effect of Neodymium (Nd3+) on Some Physiological Activities in Oilseed Rape during Calcium (Ca2+) Starvation, Zhejiang, Department of Soil Science & Agro-chemistry.
Bibliografia |
- Francesco Borgese, Gli elementi della tavola periodica. Rinvenimento, proprietà, usi. Prontuario chimico, fisico, geologico, Roma, CISU, 1993, ISBN 88-7975-077-1.
- R. Barbucci, A. Sabatini e P. Dapporto, Tavola periodica e proprietà degli elementi, Firenze, Edizioni V. Morelli, 1998 (archiviato dall'url originale il 22 ottobre 2010).
Voci correlate |
- Lantanoidi
Altri progetti |
Altri progetti
- Wikizionario
- Wikimedia Commons
 Wikizionario contiene il lemma di dizionario «neodimio»
Wikizionario contiene il lemma di dizionario «neodimio»
 Wikimedia Commons contiene immagini o altri file su neodimio
Wikimedia Commons contiene immagini o altri file su neodimio
Collegamenti esterni |
Neodimio, su thes.bncf.firenze.sbn.it, Biblioteca Nazionale Centrale di Firenze.
(EN) Neodimio, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Neodimio, Los Alamos National Laboratory.
- (EN) Neodimio, su WebElements.com.
- (EN) Neodimio, su EnvironmentalChemistry.com.
- (EN) It's Elemental – Neodymium, su education.jlab.org.
 (EN, IT) Magneti in Neodimio: la Legge di Lenz all'opera, su YouTube.
(EN, IT) Magneti in Neodimio: la Legge di Lenz all'opera, su YouTube.
.mw-parser-output .navbox{border:1px solid #aaa;clear:both;margin:auto;padding:2px;width:100%}.mw-parser-output .navbox th{padding-left:1em;padding-right:1em;text-align:center}.mw-parser-output .navbox>tbody>tr:first-child>th{background:#ccf;font-size:90%;width:100%}.mw-parser-output .navbox_navbar{float:left;margin:0;padding:0 10px 0 0;text-align:left;width:6em}.mw-parser-output .navbox_title{font-size:110%}.mw-parser-output .navbox_abovebelow{background:#ddf;font-size:90%;font-weight:normal}.mw-parser-output .navbox_group{background:#ddf;font-size:90%;padding:0 10px;white-space:nowrap}.mw-parser-output .navbox_list{font-size:90%;width:100%}.mw-parser-output .navbox_odd{background:#fdfdfd}.mw-parser-output .navbox_even{background:#f7f7f7}.mw-parser-output .navbox_center{text-align:center}.mw-parser-output .navbox .navbox_image{padding-left:7px;vertical-align:middle;width:0}.mw-parser-output .navbox+.navbox{margin-top:-1px}.mw-parser-output .navbox .mw-collapsible-toggle{font-weight:normal;text-align:right;width:7em}.mw-parser-output .subnavbox{margin:-3px;width:100%}.mw-parser-output .subnavbox_group{background:#ddf;padding:0 10px}
.mw-parser-output .CdA{border:1px solid #aaa;width:100%;margin:auto;font-size:90%;padding:2px}.mw-parser-output .CdA th{background-color:#ddddff;font-weight:bold;width:20%}
| Controllo di autorità | LCCN (EN) sh85090754 · GND (DE) 4171432-5 |
|---|